问题
计算题
(8分)为了分析碳酸钠和氯化钠固体混合物中碳酸钠的含量,某实验小组进行了实验研究,取22.3g该固体混合物与10%的CaCl2溶液反应,来分析该混合物中碳酸钠的含量,并绘制了加入CaCl2溶液质量与生成沉淀质量的关系图(见右图).
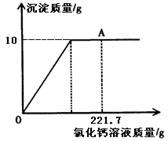
(1)求混合物中碳酸钠的质量.(写出计算过程)
(2)A点时氯化钠溶质的质量分数是 .
答案
解:(1)设碳酸钠的质量为X
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
106 100
X 10g
106/X = 100/10g
X=10.6g
(2)10%
(1)分析本题中所发生的反应为碳酸钠和氯化钙的反应,氯化钠不反应,同时分析图象可以知道生成沉淀的质量为10g,
(2)到达A点时是碳酸钠和氯化钙完全反应的时候,氯化钠主要有两个来源.
解:(1)分析本题中所发生的反应为碳酸钠和氯化钙的反应,氯化钠不反应,同时分析图象可以知道生成沉淀的质量为10g
设碳酸钠的质量为x,生成氯化钠的质量为y,
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100 117
x 10g y
106/X = 100/10g
X=10.6g
(2)A点时氯化钠溶质的质量分数=(22.3g-10.6g+11.7g)÷(221.7g+22.3g-10g)×100%=10%
答:混合物中碳酸钠的质量10.6g,A点时氯化钠溶质的质量分数是10%.
