问题
计算题
(6分)测定大理石含CaCO3的质量分数,取大理石12.5g,加入盛有100g稀盐酸的烧杯中,两者恰好完全反应(假设其他杂质不与盐酸反应,也不溶解)。烧杯内物质的质量变为108.1g。试计算:
(1) 完全反应后产生二氧化碳 g;
(2) 大理石样品中CaCO3的质量分数。
答案
(1)4.4g (2)80%
题目分析:
(1)根据质量守恒定律和化学方程式CaCO3 + 2HCl ="====" CaCl2 + H2O + CO2↑可知,产生的二氧化碳的质量为
12.5 g +100g-108.1g ="=" 4.4g
(2) 解:设样品中碳酸钙的质量为x。
CaCO3 + 2HCl ="====" CaCl2 + H2O + CO2↑
100 44
X 4.4g
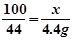
X=10g
CaCO3 %=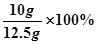 =80%
=80%
答:大理石样品中碳酸钙的质量分数为80%。
点评:利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.
