工业纯碱中常含有少量的NaCl杂质。下图是测定纯碱样品中Na2CO3质量分数的实验装置(气密性良好,样品质量为11.0 g,装置D的质量为172.2 g)。操作步骤为:将样品装入广口瓶中→打开止水夹,缓缓鼓入空气数分钟→连接装置D→关闭止水夹,向盛有样品的广口瓶中滴加稀硫酸至不再产生气泡→打开止水夹,再缓缓鼓入空气数分钟→称量装置D的质量为176.6 g。(假设每套装置均反应完全)。
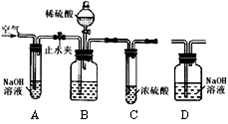
⑴若去掉C装置,则测定结果 (填序号)。
①偏大 ②偏小 ③不变 ④无法判断
⑵开始时和结束时都要缓缓鼓入空气数分钟,其目的分别是
。
⑶计算纯碱样品中Na2CO3的质量分数。
⑴①
⑵开始时:排出装置中的CO2,以免空气中CO2对结果有影响;
结束时:使生成的CO2全部被NaOH溶液吸收
⑶ 96.4%
(1)浓硫酸具有吸水性所以是用来干燥二氧化碳的;如果不用浓硫酸,就会将二氧化碳中的水分误认为是二氧化碳,会导致二氧化碳的质量偏大,算出来的碳酸钠质量也偏大,故结果偏大.
(2)开始时:排出装置中的CO2,以免空气中CO2对结果有影响;结束时:使生成的CO2全部被NaOH溶液吸收
(3)由图可以知道,装置D是来吸收二氧化碳的,所以D装置的中增加的质量即为二氧化碳的质量;可以根据二氧化碳的质量结合纯碱与稀硫酸反应的化学方程式求算出碳酸钠的质量,进而求出碳酸钠的质量分数;
解:设样品中Na2CO3的质量为x。
Na2CO3 + H2SO4 Na2SO4 + H2O + CO2↑
44
x 176.6 g-172.2 g
 x="10.6" g
x="10.6" g

