水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a. NH3·H2O b. CH3COONa c. NH4Cl d. NaHSO4
常温下呈酸性的溶液有 (填序号)。
(2)已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示: 、
,该溶液中的离子浓度由大到小的顺序是: 。
(3)有浓度均为0.1 mol•L-1的 ①盐酸②硫酸③醋酸三种溶液,请用序号填空:
三种溶液的c(H+)大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为 ;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为 。
(4)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的表达式: ,现将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)= mol/L(忽略溶液体积的变化)。
(18分)(每空各2分)(1)c.d (2)HCO3- H++CO32- HCO3-+H2O
H++CO32- HCO3-+H2O H2CO3 +OH— c(Na+)>c(HCO32—)> c(OH—) > c(H+) > c(CO32-)
H2CO3 +OH— c(Na+)>c(HCO32—)> c(OH—) > c(H+) > c(CO32-)
(3)②>①>③ ①=③>② ①=②>③
(4)AgCl(S)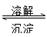 Ag+(aq)+Cl-(aq) 9×10-10
Ag+(aq)+Cl-(aq) 9×10-10
题目分析:(1)氨水是弱碱,溶液显碱性。醋酸钠溶于水,CH3COO-发生水解,溶液显碱性。氯化铵溶于水,NH4+发生水解,溶液显酸性。硫酸氢钠盐,溶于水,完全电离出氢离子,溶液显酸性,答案选cd。
(2)碳酸氢钠是弱酸的酸式盐,既有HCO3-的水解平衡,也有HCO3-的电离平衡,有关的离子方程式是HCO3- H++CO32-、HCO3-+H2O
H++CO32-、HCO3-+H2O H2CO3 +OH—。由于水解程度,大于电离程度,所以溶液显碱性,有关离子浓度的大小关系是c(Na+)>c(HCO32—)> c(OH—) > c(H+) > c(CO32-)。
H2CO3 +OH—。由于水解程度,大于电离程度,所以溶液显碱性,有关离子浓度的大小关系是c(Na+)>c(HCO32—)> c(OH—) > c(H+) > c(CO32-)。
(3)盐酸是一元缺少,硫酸是二元强酸,醋酸是一元弱酸,所以在物质的量浓度相等的条件下,三种溶液的c(H+)大小顺序为②>①>③;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为①=③>②;在稀释过程中,醋酸内继续电离出氢离子,所以稀释后三种溶液的pH的大小关系为①=②>③。
(4)AgCl溶解平衡的表达式为AgCl(S) Ag+(aq)+Cl-(aq)。溶液中氯离子的浓度是0.2mol/L,则根据氯化银的溶度积常数可知,溶液中c(Ag+)=
Ag+(aq)+Cl-(aq)。溶液中氯离子的浓度是0.2mol/L,则根据氯化银的溶度积常数可知,溶液中c(Ag+)=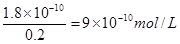
点评:该题是中等难度的试题,试题注重基础性知识的检查和巩固。该题考查的知识点比较分散,主要是围绕弱电解质的电离平衡和溶解平衡展开的,有利于培养学生的逻辑思维能力和发散思维能力,提高学生分析问题、归纳、总结问题的能力。
