在25mL 0.1mol∙L-1 NaOH溶液中逐滴加入0.1mol∙L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是在( )
A.A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
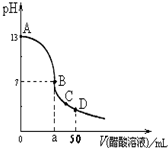
A、A、B间任一点溶液呈电中性,溶液中阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(CH3COO-)+(OH-),故A正确.
B、醋酸钠是强碱弱酸盐其水溶液呈碱性,要使溶液呈中性,酸的量应稍微大些,所以a>25;在B点溶液呈中性,即溶液中氢离子和氢氧根离子浓度相等,所以醋酸根离子和钠离子也相等,但中性溶液中水是微弱电离的,所以醋酸根离子浓度大于氢离子浓度,故B错误.
C、在C点,溶液呈酸性,溶液中氢离子浓度大于氢氧根离子浓度,根据溶液中电荷守恒知,溶液中醋酸根离子浓度大于钠离子浓度,故C正确.
D、在D点时,加入的醋酸的物质的量=0.1mol∙L-1×0.05L=0.005mol,氢氧化钠的物质的量=0.1mol∙L-1×0.025L=0.0025mol,根据物料守恒知,n(CH3COO-)+n(CH3COOH)=0.005mol,和钠离子的物质的量不相等,所以钠离子浓度与醋酸根离子浓度和醋酸浓度之和不相等,故错误.
故选AC.
