Ⅰ.如图为向25mL0.1mol•L-NaOH溶液中逐滴加入0.2mol•L-醋酸溶液过程中溶液pH的变化曲线,请回答:
(1)有人认为B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是在BD区间内?______区间.(若正确,此问不答)
(2)在AB区间内,c(OH-)>c(H-),则c(OH-)与c(CH3COO-)的大小关系是______.
A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)可能大于、小于或等于c(CH3COO-)
(3)在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+).(填“大于”,“小于”或“等于”)
Ⅱ.已知硫酸钡的Ksp为1.0×10-10,碳酸钡的Ksp为2.58×10-9,工业上却可以将硫酸钡转化为碳酸钡,请问至少需要______ mol•L-的碳酸钠溶液浸泡才能实现转化.实现此转化的离子方程式为______.
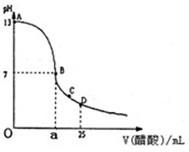
Ⅰ、(1)溶液混合后发生的反应为:NaOH+CH3COOH=CH3COONa+H20,当醋酸和氢氧化钠的物质的量之比为1:1时,反应生成的CH3COONa为强碱弱酸盐,溶液显碱性,pH>7,介于AB之间,故答案为:否、AB;
(2)在AB区间内,c(OH-)>c(H-),说明溶液显碱性,当氢氧化钠溶液和醋酸恰好反应是时,显碱性,此时生成的溶液可能为醋酸钠,c(OH-)小于c(CH3COO-);当氢氧化钠溶液和醋酸反应后剩余氢氧化钠溶液,溶液仍然显碱性,此时若剩余的氢氧化钠量很大,则c(OH-)大于c(CH3COO-),也有可能剩余的氢氧化钠和醋酸钠中醋酸根水解之后剩余的醋酸根的浓度相等,故答案为:D;
(3)在D点时,反应后醋酸剩余,溶液的组成为等浓度的醋酸和醋酸钠的混合物,根据物料守恒,此时:c(CH3COO-)+c(CH3COOH)=2c(Na+),故答案为:等于;
Ⅱ、要将硫酸钡转化为碳酸钡,此时在硫酸钡水溶液中,根据硫酸钡的溶度积Ksp=[Ba2+][SO32-]=1.0×10-10,且[Ba2+]=[SO32-],则[Ba2+]=
=1.0×10-5mol/l,碳酸钡的溶度积Ksp=[Ba2+][CO32-]=2.58×10-9,则[CO32-]=Ksp
=Ksp [Ba2+]
=2.58×10-4(mol/l),转化的离子反应方程式为:BaSO4+CO32-≒BaCO3+SO42-,故答案为:2.58×10-4,BaSO4+CO32-≒BaCO3+SO42-.2.58×10-9 1.0×10-5


