问题
计算题
称取铜、锌混合物粉末10.0g置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49.0g稀硫酸。剩余固体3.5g。则所用的稀硫酸溶质的质量分数是多少?
答案
20%
根据金属活动性可知,金属铜不能与稀硫酸发生反应,而锌与稀硫酸放出氢气;固体质量不再减少,可判断锌已完全反应,反剩余固体为不能反应的铜;混合物粉末的质量与铜的质量差即反应所消耗锌的质量,利用该质量计算出反应所消耗硫酸的质量,利用硫酸质量与所加稀硫酸质量比完成所用稀硫酸的溶质质量分数的计算.
混合物中金属锌的质量=10.0g-3.5g=6.5g
设49.0g稀硫酸中溶质H2SO4的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
6.5g x
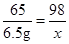
x=9.8g
所用稀硫酸的溶质质量分数=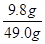 ×100%=20%
×100%=20%
