问题
计算题
现有KCl和K2CO3的固体混合物19.9g。将该固体混合物完全溶解于100g水中,再向其中加入稀盐酸,生成气体质量与所加稀盐酸的质量关系如下图所示:
(友情提示:假设生成气体全部逸出)
求:(1)反应后生成气体质量的最大值为 g;
(2)原固体混合物中K2CO3的质量;
(3)当加入84.5g稀盐酸恰好完全反应后,所得不饱和溶液中溶质的质量分数(计算结果精确到0.1%)。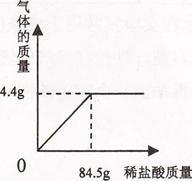
答案
(1)4.4
解:设生成4.4克二氧化碳,需要碳酸钾的质量为x,生成氯化钾质量为y
K2CO3+2HCl=2KCl+H2O+CO2↑
138 149 44
x y 4.4g
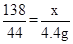
x=13.8g
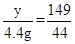
y=14.9g
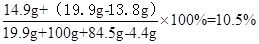
答:原混合物中含有碳酸钾质量是13.8g,加入弘84.5g稀盐酸后溶液溶质质量分数10.5%。
根据图表可知,反应后生成气体质量的最大值为4.4 g
设生成4.4克二氧化碳,需要碳酸钾的质量为x,生成氯化钾质量为y
K2CO3+2HCl=2KCl+H2O+CO2↑
138 149 44
x y 4.4g
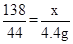
x=13.8g
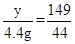
y=14.9g
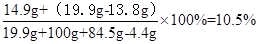
答:原混合物中含有碳酸钾质量是13.8g,加入弘84.5g稀盐酸后溶液溶质质量分数10.5%。
