食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。
42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题:
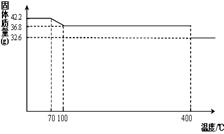
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol•L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;)
(10分)(1)K4[Fe(CN)6] (2)应避免与醋等酸性物质一起烹饪;控制烹饪温度不超过400℃
(3)> (4)10-5-10-9 (5)3
题目分析:(1)根据K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线可知,在150℃时固体物质的质量减少了42.2g-36.8g=5.4g,减少的质量即为水的质量,物质的量的是0.3mol。而原物质的物质的量是42.2g÷422g/mol=0.1mol,含有0.3mol水。这说明150℃时,水完全脱去,所以此时物质的化学式为K4[Fe(CN)6]。
(2)根据水溶液与酸反应放出极毒的氰化氢(HCN)气体,且亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)可知,烹饪食品时应注意的问题为烹饪食品时应注意的问题为应避免与醋等酸性物质一起烹饪;其次控制烹饪温度不超过400℃。
(3)KCN与盐酸恰好反应时反应生成HCN,溶液应该是显酸性的。如果溶液为中性,这说明KCN一定是过量的,即溶液的物质的量浓度a大于0.01mol•L-1。
(4)KCN溶于水水解促进水的电离,则根据电荷守恒可知c(K+)+c(H+)=c(CN_)+c(OH-)。又因为KCN溶液pH=9,所以c(K+)-c(CN_)=c(OH-)-c(H+)=(10-5-10-9)mol•L-1。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36,当铁离子浓度为10-5 mol•L-1时,溶液中OH-的浓度是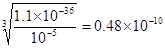 ,则氢离子浓度是2.08×10-4mol/L,则控制pH应不小于3.68。
,则氢离子浓度是2.08×10-4mol/L,则控制pH应不小于3.68。
点评:该题综合性强,浓度较大,试题贴近高考,侧重对学生能力的培养与学习方法的指导与训练,有利于培养学生的逻辑推理能力与创新思维能力,提高学生灵活运用基础知识解决实际问题的能力。过量试题主要是运用分析、比较、概括、归纳等方法对所获取的信息进行初步加工和应用的能力;能够敏捷、准确地获取试题所给的相关信息,并与已有知识整合,在分析评价的基础上应用新信息的能力。
