问题
选择题
取一定质量的CaCO3高温加热一段时间后,冷却,测得剩余固体的质量为8.0 g,剩余固体中钙元素质量分数为50.0%。下列判断正确的是
A.生成2.0 gCO2气体
B.原来CaCO3的质量为14.3 g
C.生成了5.6 gCaO
D.剩余CaCO3的质量为3.0 g
答案
答案:A
题目分析:根据碳酸钙分解的化学方程式CaCO3 CaO+CO2↑,结合质量守恒定律可知,在反应前后钙元素的质量相等,所以反应后剩余物质中钙元素的质量即为反应前碳酸钙中钙元素的质量,可以据此结合化学方程式进行解答。
CaO+CO2↑,结合质量守恒定律可知,在反应前后钙元素的质量相等,所以反应后剩余物质中钙元素的质量即为反应前碳酸钙中钙元素的质量,可以据此结合化学方程式进行解答。
根据题意可知,钙元素的质量=8.0g×50.0%=4.0g,
所以反应前碳酸钙的质量=4.0g÷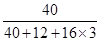 ×100%=10.0g,故B错误;
×100%=10.0g,故B错误;
根据质量守恒定律可知,生成二氧化碳的质量=10.0g-8.0g=2.0g,故A正确;
设生成氧化钙的质量为x,消耗碳酸钙的质量为y
CaCO3 CaO + CO2↑
CaO + CO2↑
100 56 44
y x 2.0g
 =
= =
=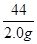
解得,x=2.55g,y=4.55g
故C错误;则剩余的碳酸钙的质量=10.0g-4.55g=5.45g,故D错误。故选A
点评:解答本题的关键有二:根据质量守恒定律中的元素守恒,利用钙元素的质量求原碳酸钙的质量;根据质量守恒定律,结合反应前后的质量变化,求出生成二氧化碳的质量。

 架上进行侧方
架上进行侧方 运动时,若平衡侧接触,工作侧不接触,应()
运动时,若平衡侧接触,工作侧不接触,应()