(12分)下表是不同温度下水的离子积数据:
| 温度 / ℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”),作出此判断的理由是________________________________________________________。
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关
系正确的是______________
A.c(Na+)>c(HCO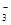 )>c(OH-)>c(H+)>c(CO
)>c(OH-)>c(H+)>c(CO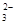 )
)
B.c(Na+)+c(H+)=c(HCO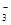 )+c(CO
)+c(CO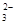 )+c(OH-)
)+c(OH-)
C.c(Na+)=c(HCO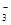 )+c(CO
)+c(CO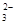 )+c(H2CO3)
)+c(H2CO3)
D.c(OH-)=c(HCO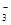 )+c(H2CO3)+c(H+)
)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________。此溶液中各种离子的浓度由大到小的排列顺序是____________________。
(1)> 温度升高,水的电离程度增大,离子积增大 (2)A、C(4分,每个2分)
(3)9∶11 c (Na+)>c (SO42-)>c (H+)>c (OH-)
题目分析:(1)水是弱电解质,存在电离平衡,电离吸热。所以温度升高,水的电离程度增大,离子积增大。
(2)25℃时饱和NaHCO3溶液的PH>7,说明碳酸氢钠的电离程度小于水解程度,A正确;B不正确,不符合电荷守恒;C正确,符合物料守恒;D不正确,不符合质子守恒,答案选AC。
(3)所得混合溶液的pH=2,说明稀硫酸过量。所以有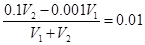 ,解得V1∶V2=9∶11。硫酸过量溶液显酸性,则溶液中各种离子的浓度由大到小的排列顺序是c (Na+)>c (SO42-)>c (H+)>c (OH-)。
,解得V1∶V2=9∶11。硫酸过量溶液显酸性,则溶液中各种离子的浓度由大到小的排列顺序是c (Na+)>c (SO42-)>c (H+)>c (OH-)。
点评:该题是高考中的常见题型,属于中等难度的试题。试题注重基础,侧重考查学生分析问题、解决问题的能力。该题的关键是明确溶液中几个重要守恒关系,即电荷守恒、物料守恒和质子守恒。
