某化学实验小组模拟高炉炼铁的化学反应原理进行了实验,其装置如下图所示,请回答下列问题:
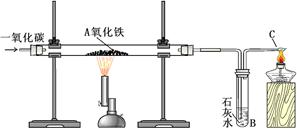
(1)A处的实验现象是 ;B处实验现象为 ;C处酒精灯的作用是 。
(2)按此原理炼铁,如生产20 t含杂质5 %的生铁,理论上需要含70 %的Fe2O3的赤铁矿 t。(保留一位小数)
(1)红色变为黑色;澄清变浑浊;燃烧未反应的一氧化碳,防止CO扩散到空气中
(2)38.8
题目分析:(1)由于通入的CO具有还原性,在高温下能够把红色的氧化铁还原为黑色的铁,同时生成二氧化碳气体,故可见玻璃管A中的现象是红色固体变为黑色,而B处的澄清石灰水会变浑浊;由于反应中会有未反应的一氧化碳从C处逸出,故要在C处放置一盏燃烧的酒精灯,可以将未反应的一氧化碳燃烧掉,从而防止CO扩散到空气中。
(2)可先根据生铁的质量和杂质的含量5%,求出生成的纯铁的质量=20t×(1-5%)=19t;再利用化学方程式中铁与氧化铁的质量比,可求出氧化铁的质量,最后除以赤铁矿中氧化铁的质量分数,即可求出赤铁矿的质量。
设需要氧化铁的质量为x
3CO+Fe2O3 3CO2+2Fe
3CO2+2Fe
160 112
X 19t
160:112= X:19
解得,x=27.14t
则赤铁矿的质量=27.14t÷70%=38.8t
答:理论上需要含70 %的Fe2O3的赤铁矿38.8t。
点评:熟记一氧化碳还原氧化铁的实验现象和操作注意事项,是解答第(1)问的关键;至于含杂质物质的化学反应的有关计算,要注意代入化学方程式计算的物质质量应为参加反应的物质质量。