问题
计算题
某校兴趣小组在实验室中完成制取氧气的实验,他们取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
| 反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| 剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
1.完全反应后,生成氧气质量为 g;
2.原混合物中氯酸钾的质量分数是多少?(精确到0.1%)
3.试画出固体物质的质量(纵坐标)随反应时间(横坐标)的变化关系图.
答案
(1)完全反应后,生成氧气质量为0.96g;
(2)81.7%
(3)试画出固体物质的质量(纵坐标)随反应时间(横坐标)的变化关系图.

题目分析:由题意得:1.完全反应后,生成氧气质量为3.0g-2.04g=0.96g。
2.解:设原混合物中氯酸钾的质量是X。
2KClO3  2KCl+ 3O2↑
2KCl+ 3O2↑
245 96
X 0.96g
245:96=X:0.96g
X=2.45g
原混合物中氯酸钾的质量分数是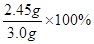 =81.7%。
=81.7%。
3.反应中固体物质的质量(纵坐标)随反应时间(横坐标)的变化关系图为: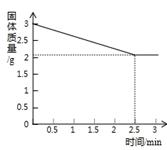
点评:题中二氧化锰是催化剂,只改变化学反应的速率,不影响产生氧气的质量。
根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
