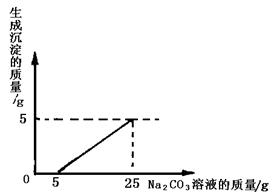
(3分)某化学小组同学用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳后,利用所得废液测定一瓶Na2CO3溶液中溶质的质量分数。他们将废液过滤,然后向滤液中慢慢滴加该Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如下图所示。(反应的化学方程式为Na2CO3+CaCl2= CaCO3↓+2NaCl)。
请回答:
(1)该瓶废液中的溶质有_______________________(写化学式)。
(2)计算这瓶Na2CO3溶液中溶质的质量分数。(写出计算过程)
题目分析:(1)所得废液是由碳酸钙和盐酸反应所制得,故废液中肯定含有生成的氯化钙;再根据反应的图像分析,废液和碳酸钠溶液反应开始时并没有沉淀生成,说明废液中还含有过量的盐酸,故该瓶废液中的溶质有CaCl2 、HCl;
(2)由于盐酸的量不确定,所以可以分析碳酸钠溶液质量从5g到25g的变化,由图可看出,20g碳酸钠溶液和废液反应生成碳酸钙沉淀的质量为5g,可由碳酸钙的质量,根据碳酸钠与氯化钙反应的化学方程式求出碳酸钠的质量,进而求出其质量分数。
解:由图像可知,(25g-5g="20g)" Na2CO3溶液与氯化钙溶液全部反应,且生成5g碳酸钙沉淀。
设:20gNa2CO3溶液中溶质的质量为x
Na2CO3+CaCl2= CaCO3↓+2NaCl
106 100
x 5g
106:100=x:5g
解得x="5.3g"
则该Na2CO3溶液中溶质的质量分数为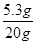 ×100%="26.5%"
×100%="26.5%"
答:这瓶Na2CO3溶液中溶质的质量分数为26.5%。
点评:此题是关于化学方程式及溶质质量分数的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力;解答本题的关键是要分析图表的数据对应的反应,在计算碳酸钠的质量分数时要注意数据的对应性,如所求碳酸钠的质量是通过20g碳酸钠溶液求出的,不是25g溶液。
