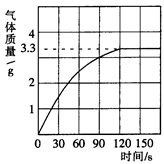
(3分)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如下图所示。
(友情提示: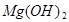 +2HCl=
+2HCl=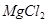 +H2O)
+H2O)
(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是 g。
(2)水垢中碳酸钙的质量分数是多少?
(3)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,溶解12.5 g水垢,至少需要质量分数为10%的盐酸的质量是 (最后结果保留一位小数)。
(1)3.3g;(2)60%;(3)117.7g
题目分析:(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是3.3g;
(2)设12.5g水垢中碳酸钙的质量为x
CaCO3+ 2HCl==CaCl2+H2O+CO2↑
100 44
x 3.3g
100:44=x:3.3g
x =7.5g
水垢中碳酸钙的质量分数为: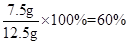 。
。
(3)12.5 g水垢中含有碳酸钙7.5g,含有氢氧化镁12.5-7.5=5g。
设反应碳酸钙的稀盐酸的质量为m;反应氢氧化镁的稀盐酸的质量为n。
CaCO3+ 2HCl==CaCl2+H2O+CO2↑
100 73
7.5g m·10%
100:73=7.5g:m·10%
m=54.8g
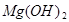 +2HCl=
+2HCl=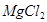 +H2O
+H2O
58 73
5g n·10%
58:73=5g:n·10%
n=62.9g
故溶解12.5 g水垢,至少需要质量分数为10%的盐酸的质量是54.8g+62.9g=117.7g。
答:12.5g水垢与盐酸反应后生成的二氧化碳最多是3.3g;水垢中碳酸钙的质量分数是60%;溶解12.5 g水垢,至少需要质量分数为10%的盐酸的质量是117.7g。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。混合物中某成分的质量分数= 。
。
