问题
计算题
(4.5分) 10g石灰石与100g盐酸恰好完全反应,生成CO2质量为2.2g,求:
(1)石灰石中CaCO3的质量分数;
(2)反应后所得溶液中溶质质量分数是多少?
答案
50% 5.4%
题目分析:(1)、解:设石灰中的CaCO3的质量为X。
CaCO3+2HCl=CaCl+H2O+CO2
100 44
X 2.2g
100/44=X/2.2g
X=5g
CaCO3%=(5g/10g)×100%=50%
(2)、解:设反应后生成CaCI2的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2
100 111
5g y
100/111=5g/y
y=5.55g
溶液总质量:10g+100g-2.2g-(10g-5g)=102.8g
CaCl2%=5.55g/102.8g≈5.4%
答:(1)石灰石中CaCO3的质量分数为50%;
(2)反应后所得溶液中溶质质量分数是5.4%。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
溶质质量分数=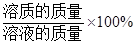 。
。