(3分)小刚想用贝壳(主要成分为碳酸钙)制取二氧化碳气体。为测定贝壳中碳酸钙的含量,他做了如下实验:首先称取50g贝壳样品于烧杯中,烧杯质量为100克。然后将150g的盐酸平均分5次加入(假设杂质均不溶于水也不与盐酸反应)到烧杯中。实验过程中的数据记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 烧杯+剩余物质质量 | 175.6g | X | 226.8g | 252.4g | 280.2g |
(2)贝壳样品中碳酸钙的质量分数;
(3)第三次实验后所得溶液中溶质的质量分数。
(1)201.2
(2)90%
(3)31.2%。
题目分析:由题中数据可知,第一次向固体中加入盐酸后,反应产生的二氧化碳气体的质量为:100+50+30-175.6=4.4g;第二次加入盐酸后,烧杯和反应剩余物质的质量应为175.6+30-4.4=201.2g。
(2)解:反应中产生的二氧化碳气体质量为50g+100g+150g-280.2g=19.8g
设50g贝壳样品中碳酸钙的质量为x
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 44
x 19.8g
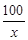 =
=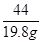
x = 45g
贝壳样品中碳酸钙的质量: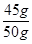 ×100%=90%
×100%=90%
答:贝壳样品中碳酸钙的质量分数是90%。
(3)第三次实验后产生的二氧化碳气体质量为4.4×3=13.2g,所得溶液中溶质是氯化钙。
设消耗碳酸钙的质量为x,产生氯化钙的质量为y
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 111 44
x y 13.2g
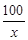 =
=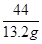
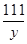 =
=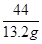
x = 30g y = 33.3g
溶液中溶质的质量分数: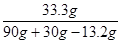 ×100%=31.2%
×100%=31.2%
答:溶液中溶质的质量分数31.2%。
点评:解答本题的关键是要根据题中数据,分析反应产生的二氧化碳的质量。
根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
溶液中溶质的质量分数=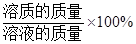 。
。
