问题
计算题
(3分)28.7g的氯化钠和硝酸钠的混合物,溶于100g水中,向所得溶液中加入134g的硝酸银溶液,恰好完全反应,得到溶液的质量是234g。计算:原混合物中钠元素的质量分数。(已知:AgNO3 + NaCl =" AgCl↓+" NaNO3;计算结果精确到1%)
答案
32%
题目分析:由题意可知,反应生成沉淀的质量是:(28.7g +100g +134g)﹣234g = 28.7g,解:设混合物中氯化钠的质量是x
NaCl + AgNO3 = AgCl↓+ NaNO3
58.5 143.5
x 28.7 g
58.5:143.5=x:28.7g
X=11.7g
则硝酸钠的质量为28.7g-11.7g=17g
设氯化钠中钠元素质量为y ;硝酸钠中钠元素的质量为z
NaCl ~ Na
58.5 23
11.7g y
58.5:23=11.7g:y
y=4.6g
NaNO3 ~ Na
85 23
17g z
85:23=17g:z
z=4.6g
故,混合物中钠元素的质量分数=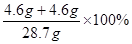 =32%
=32%
答:混合物中钠元素的质量分数为32%。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
化合物中元素的质量比是固定的,故可以根据化合物中元素的固定质量比来求算元素的质量。
