(6分)我省各地都有丰富的石灰石矿产资源。有一矿山上的石灰石样品,其中只含二氧化硅杂质(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体)。小琳和他的同学想测定该样品中碳酸钙的的质量分数,他们取了一块石灰石样品,将其敲打粉碎后,称出6g放入烧杯内(烧杯的质量为20g),然后加入50g某一定溶质质量分数且足量的稀盐酸,用玻璃棒搅拌至不在产生气泡为止。反应所需时间(t)和烧杯及其所盛物质的总质量(m)的关系如右图所示。

试回答:
(1)将石灰石样品敲打粉碎的主要目的是 。
(2)实验结束后,共放出多少二氧化碳?
(3)该石灰石样品中碳酸钙的质量分数是多少?(计算结果保留1位小数)
(1)增大接触面积,加快反应速率
(2)2.2g (3)83.3%
题目分析:(1)为了避免样品中碳酸钙不能完成反应,可把样品粉碎,这样能增大样品与盐酸的接触面积,使反应更充分,同时还可以加快反应的速率。
(2)由图可以看出,在t3时,石灰石样品中的碳酸钙已完全反应,故剩余物质总质量为73.8g,根据质量守恒定律,可知放出气体二氧化碳的质量=20g+6g+50g-73.8g=2.2g。
(3) 利用生成的二氧化碳的质量,结合化学方程式中二氧化碳与碳酸钙的质量比,可计算出所取样品中碳酸钙的质量,最后用碳酸钙质量除以样品总质量,即可求出样品中碳酸的质量分数。
设6g石灰石样品中所含碳酸钙的质量为X,则
CaCO3+2HCl = CaCl2 + CO2↑+H2O
100 44
x 2.2g
100:44=x:2.2g
解得x="5g"
所以该石灰石样品中碳酸钙的质量分数=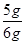 ×100%="83.3%"
×100%="83.3%"
答:该石灰石样品中碳酸钙的质量分数是83.3%。
点评:此题是关于化学方程式的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生要有较强的数据分析能力;解题的关键是要会利用质量守恒定律,由反应前后质量的变化计算出反应放出的二氧化碳的质量,然后再根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可。
