右图是用0.1mol•L-1 CH3COOH溶液滴定20mL 0.1mol•L-1NaOH溶液的滴定曲线.该溶液中有关粒子浓度的关系式不正确的是( )
A.当pH=7时:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
B.在a点时:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.在b点时:c(OH-)=c(H-)+c(CH3COO-)+2c(CH3COOH)
D.在c点时:c(Na+)+c(H+)+c(CH3COOH)-c(OH-)=0.05mol•L-1
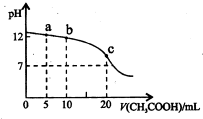
A、PH=7时,c(OH-)=c(H+),根据溶液电中性可判断c(Na+)=c(CH3COO-),此时溶液中c(Na+)稍小于0.05mol/L,而c(OH-)=1×10-7mol/L,则c(Na+)>c(OH-),所以有
c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故A正确;
B、在a点时,加入醋酸为5ml,NaOH过量c(Na+)>c(CH3COO-),故B错误;
C、在b点时,加入醋酸为10ml,溶液中c(CH3COO-)+c(CH3COOH)=
,c(Na+)=0.1mol/L 3
,即c(Na+)=2c(CH3COO-)+2c(CH3COOH),溶液中存在c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则有2c(CH3COO-)+2c(CH3COOH)+c(H+)=c(OH-)+c(CH3COO-),即c(OH-)=c(H-)+c(CH3COO-)+2c(CH3COOH),故C正确;0.2mol/L 3
D、在c点时,加入醋酸为20ml,两种溶液等体积混合,溶液中c(CH3COO-)+c(CH3COOH)=0.05mol•L-1,c(Na+)=0.05mol•L-1,
则有c(CH3COO-)=0.05mol•L-1-c(CH3COOH),溶液中存在c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则有c(Na+)+c(H+)=c(OH-)+0.05mol•L-1-c(CH3COOH),所以有c(Na+)+c(H+)+c(CH3COOH)-c(OH-)=0.05mol•L-1,故D正确.
故选B.
