称取NaCl和BaCl2的固体混合物32、5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示.试回答下列问题:(提示:BaCl2+Na2SO4═BaSO4↓+2NaCl)
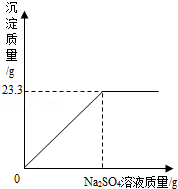
(1)完全反应后生成BaSO4沉淀 g.
(2)恰好完全反应时消耗Na2SO4溶液的质量是多少克?
(3)恰好完全反应时所得溶液中溶质的质量分数是多少?(精确到0.1%)
(1)23.3 (2)142 (3)9.3%
题目分析:(1)从图中可明显看出生成23.3g沉淀后质量不再增加,故完全反应后生成BaSO4沉淀的质量为23.3g;
故答案为:23.3
设BaCl2的质量为x,反应生成的NaCl的质量为y;恰好完全反应时消耗Na2SO4的质量为z
BaCl2+Na2SO4═BaSO4↓+2NaCl
208 142 233 117
x z 23.3g y
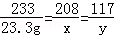 =
=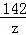
x=20.8g
y=11.7g
z=14.2g
(2)恰好完全反应时消耗Na2SO4溶液的质量为:14.2g÷10%=142g
故答案为:142
(3)恰好完全反应时,溶液中NaCl的质量为:11.7g+(32.5g﹣20.8g)=23.4g
恰好完全反应时所得NaCl 溶液溶质的质量分数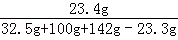 ×100%=9.3%
×100%=9.3%
答:恰好完全反应时所得NaCl 溶液溶质的质量分数为9.3%
点评:求反应后所得溶液的质量的方法一般是用所加的所有物质的质量总和﹣生成气体的质量﹣生成沉淀的质量.
