问题
计算题
(3分) 有一种自生氧防毒面具,其使用的生氧剂的主要成分是KO2。某研究小组取100 g生氧剂放入装置A中,加入足量水使之充分反应(4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量。他们进行了三次实验,测定结果如下:
| 测定序号 | 第1次 | 第2次 | 第3次 | 平均值 |
| 反应前装置A总质量(g) | 400.1 | 400.2 | 399.7 | 400.0 |
| 反应后装置A总质量(g) | 376.1 | 376.1 | 375.8 | 376.0 |
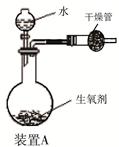
(1)100 g 生氧剂与水反应生成的氧气质量;
(2)生氧剂中含钾元素的质量分数。
答案
(1)24g
题目分析:解:(1)由题意可得,100g生氧剂与水反应生成的氧气质量为400g-376g=24g。
(2)设生氧剂中KO2的质量为x.
4KO2+2H2O=4KOH+3O2↑
284 96
x 24g
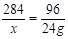
x=71g
生氧剂中钾元素的质量分数: ×100% =39%
×100% =39%
答:(1)100g生氧剂与水反应生成的氧气质量为24g。
(2)该生氧剂中钾元素的质量分数是39%。
点评:本题难度较大,根据题意得出100g生氧剂与水反应生成的氧气质量为24g,是解题的突破口,在根据化学方程式计算的过程中要注意解题步骤。
