问题
计算题
金属单质A与非金属单质硫(S)发生如下反应: A + S  AS。甲、乙、丙三组学生在实验室分别进行该实验,加入的A和硫的质量各不相同,但总质量均为12g。 分别反应时,实验数据记录如下:
AS。甲、乙、丙三组学生在实验室分别进行该实验,加入的A和硫的质量各不相同,但总质量均为12g。 分别反应时,实验数据记录如下:
| A的质量/ g | S的质量/ g | AS的质量/ g | |
| 甲 | 8 | 4 | 11 |
| 乙 | 7 | 5 | 11 |
| 丙 | a | b | 6.6 |
(1)元素A的相对原子质量。
(2)丙组实验中a∶b为 (结果以最简整数比表示)。
答案
(1)56 (2) a : b = 21:39 a : b = 4:1
题目分析:(1)解:对比甲、乙两同学所用A和S的质量及生成AS的质量:同样生成11gAS,甲实验S的用量为4g、乙实验S的用量为5g,则可得反应生成11gAS时需要消耗S的质量为4g;利用质量守恒定律,可判断生成11gAS时消耗A的质量为7g,则两物质恰好完全反应时,A、S两物质的用量比为7:4;
设元素A的相对原子质量是x
A + S  AS
AS
x 32
7g 4g
x:32=7g:4g
x=56
(2)根据反应中反应物A、S两物质的质量比为7:4及质量守恒定律,由于丙同学实验中生成AS的质量6.6g,若A的用量=6.6g×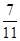 =4.2g,此时S的用量=12g-4.2g=7.8g;若S的用量=6.6g×
=4.2g,此时S的用量=12g-4.2g=7.8g;若S的用量=6.6g×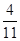 =2.4g,此时A的用量为12g-2.4g=9.6g,故a:b=21:39或a:b=4:1。
=2.4g,此时A的用量为12g-2.4g=9.6g,故a:b=21:39或a:b=4:1。
答:(1)元素A的相对原子质量为56。
(2)丙组实验中a∶b为a:b=21:39或a:b=4:1。
点评:本题难度较大,根据题意判定出A和S反应的质量比是解题的关键,在计算a、b的比时,要分两种情况讨论a、b的比。




