某混合物的水溶液中,可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、Cl-、CO32-和SO42-。现每次取100.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
请回答:
(1)c(CO32-)=______________。
(2)用离子方程式表示该溶液呈碱性的原因:____________________________________。
(3)K+是否存在?_____,(填“是”或“否”)若存在,浓度范围是______________________ (若不存在,则不必回答第(2)问)。
(4)根据以上实验,不能判断哪种离子是否存在?若存在,这种离子如何进行检验?
____________________________________________________________________。
(1) 0.2mol·L-1(2分)
(2)CO32-+H2O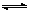 HCO3-+OH-(2分)
HCO3-+OH-(2分)
(3)是(2分) c(K+)≥0.6mol·L-1(2分)
(4)Cl-;取原溶液少许,加入足量Ba(NO3)2溶液后过滤,向滤液中加入AgNO3溶液,若有沉淀产生,则原溶液中有Cl-,反之无Cl-(3分)
题目分析:第一份加入AgNO3溶液有沉淀产生,则沉淀有可能是硫酸银(微溶)、碳酸银(不溶)或氯化银(不溶);第二份得沉淀后加盐酸,沉淀变少,说明2.33g是硫酸钡,6.27-2.33=3.94g是碳酸钡,所以碳酸钡为3.94g÷188g/mol=0.02nol,则c(CO32-)=0.2mol·L-1。(3)因为溶液存在CO32-和SO42-,所以一定不存在Mg2+、Fe3+、Al3+,则一定K+;硫酸钡为0.01mol,碳酸钡为0.02nol,则负电荷最少为0.06mol,故K+的浓度最少为0.6mol·L-1。(4)硫酸银(微溶)、碳酸银(不溶),所以不能判断第一份的沉淀是否有氯化银,故无法判断是否有Cl-。
点评:离子共存问题是历年高考的重点,考生在备考中要注意积累常见的化学反应,并注意题文中隐藏的条件。
