(3分)某二价金属M的氧化物10 g与90 g稀硫酸恰好完全反应后,形成无色透明溶液,测得反应后溶液中溶质的质量分数为30% 。请计算(保留一位小数):
(1)该金属M的相对原子质量和上述稀硫酸中溶质的质量分数。
(2)反应后的溶液中,氢元素与氧元素的质量比。
(1)24 27.2% (2)35:352
题目分析:(1)二价金属M的氧化物的化学式可以表示为MO,金属氧化物与硫酸反应生成金属M的硫酸盐和水,故该反应的化学方程式为MO+H2SO4=MSO4+H2O,根据质量守恒定律,反应后所得溶液质量=10g+90g=100g,所以反应后的溶液中溶质质量=100g×30% =30g。
根据反应的化学方程式中,金属氧化物与所生成硫酸盐的质量比,以及硫酸与所生成硫酸盐的质量比,利用硫酸盐的质量,可计算出金属M的相对原子质量,及反应消耗硫酸的质量,进而可求出稀硫酸中溶质的质量分数。
设金属M的相对原子质量为m,稀硫酸中H2SO4的质量为x
MO + H2SO4 = MSO4 + H2O
m+16 98 m+96
10g x 30g
(m+16):(m+96)= 10g:30g
解得m=24
98:x =(m+96):30g
解得x=24.5g
则稀硫酸中溶质质量分数=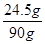 ×100%=27.2%
×100%=27.2%
(2)由于二者恰好完全反应,故所得的溶液为硫酸盐的溶液,其中氢元素全部含在溶剂水中,而氧元素则分别含在水和溶质硫酸盐中,利用水和硫酸盐的质量关系,可计算溶液中氢、氧元素质量比。
已知反应后的溶液中MSO4的质量分数为30%,则H2O为70%
即水与硫酸盐的质量比为m (H2O) :m (MSO4) =70:30 =7:3
设水的质量为7,则硫酸盐的质量为3
所以氢氧元素的质量比为m (H) :m (O)=(7×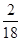 ):(7×
):(7×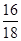 +3×
+3×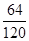 )=35:352。
)=35:352。
点评:这是一道关于化学方程式及溶质质量分数的计算题,要求学生有较强的分析能力,解答时,要能先根据反应原理,以及反应后的溶液和溶质质量分数,来求出生成的硫酸盐的质量,然后再根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。
