问题
计算题
某课外活动小组为了测定铜铁合金中铁的质量分数,现取铜铁合金样品20.0g,将80.0g稀硫酸平均分成4份,分4次逐渐加入到样品中,每次充分反应后测得剩余固体质量 见下表:
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 20.0 | 20.0 | 20.0 | 20.0 |
| 剩余固体质量/g | 17.2 | 14.4 | 13.0 | X |
(2)求稀硫酸中溶质质量分数为多少?(答案保留0.1%,写出解题过程)
答案
13.0 35% 24.5%
题目分析:由于稀硫酸只能和合金中的铁反应,因此每加入20克稀硫酸后,固体的减少量,即为消耗的铁的质量,从图中不难看出,每20克稀硫酸最多消耗2.8克铁,而当第三次加入20克稀硫酸时固体却只减少了1.4克,说明固体中的铁已完全反应,剩余的13克固体均为铜。
(1)第四次再加入20克稀硫酸,由于铜不反应,故剩余质量不变,仍为13克。
则铜铁合金中铁的质量分数= 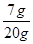 ×100%═35%;
×100%═35%;
(2)由于只有前两次的稀硫酸是完全反应,因此要求稀硫酸中溶质质量分数,只能根据前两次的量计算。
设20g稀硫酸中含溶质质量为x
Fe + H2SO4 = FeSO4 + H2↑
56 98
2.8g x
56:98 ="2.8g" :x
解得x=4.9g
则稀硫酸中溶质质量分数=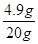 ×100%=24.5%
×100%=24.5%
答:稀硫酸中溶质质量分数为24.5%。
点评:此题是关于化学方程式及溶质质量分数的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力;解题的关键是要明确第几次加入稀硫酸后铁已完全反应,然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。
