将硫酸钠和氯化钠的固体混合物35克放入烧杯中,加入161.6克水后,固体混合物完全溶解,取此溶液一半,加入75克氯化钡溶液恰好完全反应,生成沉淀23.3克.计算:
(1)原固体混合物中硫酸钠的质量分数(精确到0.1%).
(2)反应后所得溶液中溶质的质量分数.
(3)往上述反应后所得溶液中再加50克水后,溶液中溶质质量分数是多少?
(1)81.1% (2)10% (3)7.5%
题目分析:(1)设原固体混合物中硫酸钠的质量为x,生成的氯化钠的质量为y.
BaCl2+Na2SO4=BaSO4↓+2NaCl
142 233 117
x 23.3g y
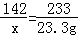
x=14.2g
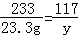
y=11.7g
原固体混合物中硫酸钠的质量分数=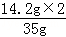 ×100%=81.1%
×100%=81.1%
(2)反应后所得溶液中溶质质量=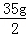 ﹣14.2g+11.7g=15g
﹣14.2g+11.7g=15g
反应后所得溶液的质量=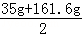 +75g﹣23.3g=150g
+75g﹣23.3g=150g
反应后所得溶液中溶质的质量分数=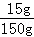 ×100%=10%
×100%=10%
(3)反应后所得溶液中再加50克水后,溶液中溶质质量分数=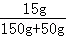 ×100%=7.5%
×100%=7.5%
答:(1)原固体混合物中硫酸钠的质量分数为81.1%.
(2)反应后所得溶液中溶质的质量分数为10%.
(3)往上述反应后所得溶液中再加50克水后,溶液中溶质质量分数是7.5%.
点评:本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律.本考点主要出现在计算题中.
