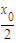下列叙述正确的是
A.相同温度下,中和pH=1的盐酸和醋酸各20.0mL,需要0.100 mol·L-1NaOH都是20.0mL
B.0.1mol·L-1Na2CO3中加入少量NaOH固体后振荡,c(Na+)和c(CO32-)都增大
C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大
D.相同浓度的CH3COOH和 CH3COONa溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)=2c(Na+)
BD
题目分析:c(H+)=10—pHmol/L=0.1mol/L,HCl完全电离,CH3COOH部分电离,则c(HCl)= 0.1mol/L,c(CH3COOH)>0.1mol/L,由于n=c•V,则n(HCl)<n(CH3COOH),因此醋酸消耗NaOH溶液的体积较多,大于20.0mL,故A选项错误;由于Na2CO3=2Na++CO32—,钠离子不水解,碳酸根离子存在水解平衡,即CO32—+H2O HCO3—+OH—,则向稀碳酸钠溶液中加入少量NaOH固体时,钠离子和氢氧根离子浓度均增大,增大生成物浓度,导致碳酸根离子的水解平衡向逆反应方向移动,则碳酸根离子浓度增大,故B选项正确;氯化银是难溶电解质,因此其悬浊液中存在沉淀溶解平衡,即AgCl(s)
HCO3—+OH—,则向稀碳酸钠溶液中加入少量NaOH固体时,钠离子和氢氧根离子浓度均增大,增大生成物浓度,导致碳酸根离子的水解平衡向逆反应方向移动,则碳酸根离子浓度增大,故B选项正确;氯化银是难溶电解质,因此其悬浊液中存在沉淀溶解平衡,即AgCl(s) Ag++Cl—,氯化纳是易溶易电离物,加入少量NaCl固体,增大氯离子浓度,上述平衡向逆反应方向移动,析出氯化银沉淀,氯化银的溶解度减小,但温度不变平衡常数不变,则Ksp(AgCl)不变,故C选项错误;由于n=c•V,则n(CH3COONa)=n(CH3COOH),根据物料守恒原理可得,混合溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),故D选项正确。
Ag++Cl—,氯化纳是易溶易电离物,加入少量NaCl固体,增大氯离子浓度,上述平衡向逆反应方向移动,析出氯化银沉淀,氯化银的溶解度减小,但温度不变平衡常数不变,则Ksp(AgCl)不变,故C选项错误;由于n=c•V,则n(CH3COONa)=n(CH3COOH),根据物料守恒原理可得,混合溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),故D选项正确。