某化学实验小组的同学要测定某铁合金中铁元素质量分数(所含有的其他成分,不参加反应,且不溶于水), 他们的做法是:将7g铁合金样品粉碎,滴加14.6%的稀盐酸,至不再产生气泡时,恰好用去稀盐酸50g,请根据题意信息回答下列问题;
(1)铁合金样品溶解的化学方程式为 ;
(2)求解样品中铁的质量(X)的比例式 ;
(3)此铁合金样品中铁的质量分数 ;
(4)将最后所得的固液混合物过滤,除去不溶物,并在反应后溶液中加入44.6g水,则最后所得溶液的溶质质量分数为 ;
(5)欲炼制6300t该铁合金需要含氧化铁80%的赤铁矿石的质量为 。
(1)Fe+2HCl=FeCl2+H2↑;(2)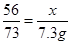 ;(3)80%;(4)12.7%;(5)9000t。
;(3)80%;(4)12.7%;(5)9000t。
题目分析:铁和稀盐酸反应生成氯化亚铁和氢气;
设求解样品中铁的质量为 。
。
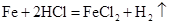
56 73
 14.6%
14.6% 50g
50g

 =5.6g
=5.6g
样品中铁的质量的比例式为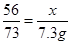
此铁合金样品中铁的质量分数为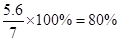
根据反应式设生成的氯化亚铁质量为 ,生成的氢气质量为z,则有
,生成的氢气质量为z,则有
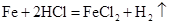
73 127 2
14.6% 50g
50g  z
z

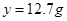 z=0.2g
z=0.2g
所得溶液的质量为:5.6g+50g+44.6g-0.2g=100g
最后所得溶液的溶质质量分数为:
设需要含氧化铁80%的赤铁矿石的质量为m。
炼铁的方程式为


160 112
80%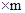
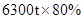

解得m=9000t
点评:化学方程式的计算属于中考重点要求掌握的内容,每年必考,最后一道压轴题中一定会是这种题型,考生要多练多总结。