已知氯化镁样品中含有杂质氯化钠,某化学兴趣小组的同学通过以下实验测定其中氯化镁的质量分数:称取该样品15g溶于水得到溶液,然后将一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡(实验数据见下表)。
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
| 生成沉淀的质量/g | 2.9 | x | 8.7 | 8.7 |
(2)样品中氯化镁的质量分数是 。
(3)若实验室中只有80g质量分数为30%的氢氧化钠溶液,要想配成本实验所需溶质质量分数的氢氧化钠溶液,还需加入水的质量是多少?
(1)5.8 (2)95% (3)70g
题目分析:(1)由表中1、3两次的数据可知,每次加入25g氢氧化钠溶液,都能与氯化镁反应能生成2.9g沉淀,因此第2次,一共加入50g氢氧化钠溶液能生成5.8g沉淀。
(2)由生成沉淀的总质量,根据氯化镁与氢氧化钠反应的化学方程式,可以计算出氯化镁的质量,进而计算出样品中氯化镁的质量分数。
设样品中氯化镁的质量为x
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 58
x 8.7g
95:58 =x:8.7g
解得,x=14.25g
则样品中氯化镁的质量分数=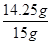 ×100%=95%;
×100%=95%;
(3)要想配成本实验所需溶质质量分数的氢氧化钠溶液,需先计算出氢氧化钠的质量分数,再根据溶液稀释的过程中,溶质不变分析。
解:设25g氢氧化钠溶液中含氢氧化钠的质量为x 。
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
80 58
x 2.9g
80:x = 58:2.9g
解得,x=4g
则本实验所需氢氧化钠溶液的质量分数为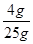 ×100%=16%,
×100%=16%,
设需要加水的质量为y
80g×30% =(80g + y)×16%
解得y=70g
答:还需加入水的质量是70g。
点评:此题是关于化学方程式的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力;解题的关键是要明确哪几次的氢氧化钠溶液是完全反应的,然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。