碱式碳酸镁密度小,是橡胶制品的优良填料。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
【探究一】碱式碳酸镁的制备
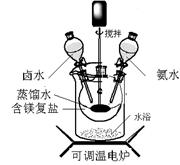
碱式碳酸镁可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的该复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始分解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120 ℃干燥得到碱式碳酸镁产品。
回答下列问题:
(1)①搅拌的目的是 ;②选择水浴加热方式,其优点是 。
(2)所得碱式碳酸镁产品中常检出有少量Cl-,其原因是混有 (填化学式)。
(3)设计实验检验碱式碳酸镁中含有Cl-
| 实验操作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸。 ②再向上述所得溶液加 溶液 | 现象① ; 现象② ; | 含有 Cl- |
|
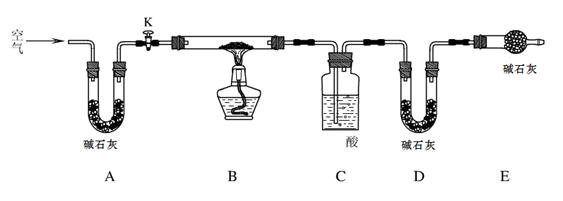
实验步骤:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: (请补充该步操作内容)。
步骤5:称量相关装置的质量。
某同学在实验过程中采集了如下数据:
A.反应前玻璃管的质量100.0 g
B.反应后玻璃管与残留固体总质量120.0 g
C.装置C实验后增重9.0 g
D.装置D实验后增重17.6 g
回答下列问题:
(1)检查整套实验装置气密性的方法如下:将装置A的左端、装置E的右端分别接上导管,放入盛有水的烧杯中, ,对装置B用酒精灯微热,观察,若 ,则气密性良好;
(2)如果没有装置A,则测定得到的Z值 (填“偏大”、“偏小”、“无影响”),
装置C中的酸为 (写名称);
(3)根据实验测定的数据,求出碱式碳酸铜(xMgCO3·yMg(OH)2·zH2O)
中x∶y∶z= (要求写出过程,4分)。
【交流反思】
(4)如果不称量装置C实验前后的增重,要根据实验数据,求出x∶y∶z的值,还可测量的实验数据是 。
【探究一】
(1)①使反应物充分混合接触,提高反应速率 ②反应物均匀受热
(2)NH4Cl
(3)步骤②硝酸银或AgNO3 现象①产生气泡 现象②白色沉淀
【探究二】
步骤4:打开活塞K,再次鼓入空气
(1)打开活塞K开关 若两端导管口处均出现气泡
(2)偏大 浓硫酸(浓字没有不得分)
(3)4∶1∶4
(4)样品的质量
题目分析:(1)①搅拌的目的是使反应物充分混合接触,提高反应速率,②此反应采用水浴加热的优点是反应物均匀受热;(2)因为混有氯化铵所以常检查出有氯离子;(3)先加入硝酸除去碳酸根离子的干扰,再加入硝酸银,有白色沉淀生成说明确实有氯离子存在。【探究二】步骤4:打开活塞K,再次鼓入空气,(1)检查整套实验装置气密性的方法如下:将装置A的左端、装置E的右端分别接上导管,放入盛有水的烧杯中,打开活塞K开关对装置B用酒精灯微热,观察,若若两端导管口处均出现气泡则气密性良好;(2)如果没有装置A,空气中的二氧化碳会干扰实验,是C、D的质量增大,C装置中盛放的是浓硫酸。
(3)xMgCO3·yMg(OH)2·zH2O ="(x+y)MgO" + xCO2↑+ (y+z) H2O
40 (x+y) 44x 18(y+z)
20 g 17.6 g 9.0 g
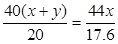 得x=4y
得x=4y
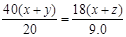 得x=z
得x=z
由于x、y、z都为正整数,得x=" 4" y="1" z=4
(4)如果不称量装置C实验前后的增重,要根据实验数据,求出x∶y∶z的值,还可测量的实验数据是样品的质量。
点评:本题较为综合,是集实验探究和化学方程式计算于一体的题目,题目较为冗长,属于较难的题目,在中考中常作为压轴题出现。
