科研、生产中常涉及钠、硫及其化合物。
(1)工业上用Na2CO3溶液处理水垢中的CaSO4,反应的离子方程式为___________________;实验室中,Na2S溶液长期放置有硫析出,原因为___________________(用离子方程式表示)。
(2)下图是大型蓄电系统的示意图。左右两侧为电解质储罐,中央为电池,反应原理为: ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
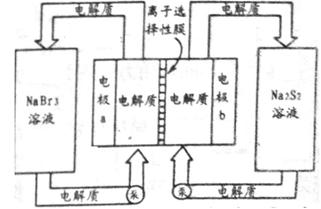
当蓄电池放电时,电池中Na+的移动方向是_________(填“a→b”或“b→a”),电极a的电极反应式为_______________;当蓄电池处于充电状态时,电极b的电极反应式为___________。用该电池做电源,采用惰性电极电解200 mL 1 mol·L-1的AgNO3溶液,当阴极质量增加2.16 g时,电解后溶液的pH为_________(不考虑溶液体积变化)。
(3)工业上,用Na2SO3溶液作为吸收液可吸收烟气中的SO2,吸收SO2过程中,溶液pH与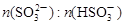 关系如下表:
关系如下表:
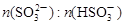 | 91∶9 | 1∶1 | 9∶91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用平衡原理解释:__________________。
②当溶液呈中性时,溶液中离子浓度的大小关系为_____________________________。
(1)CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq)
2S2-+O2+2H2O=S↓+4OH-
(2)b→a Br3-+2e-=3Br‑ S42- + 2e-=2S22- 1
(3)①酸 在HSO3-溶液中存在以下两个平衡HSO3-+ H2O H2SO3+OH-,HSO3-
H2SO3+OH-,HSO3- SO32-+H+,其中以电离为主,故溶液为酸性。
SO32-+H+,其中以电离为主,故溶液为酸性。
② C(Na+)>C(HSO3-)>C(SO32-)>C(OH-)=C(H+)
题目分析:(1)该反应为沉淀的转化,CaSO4微溶于水,离子方程式中要写化学式,
CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),不写状态也可以;2S2-+O2+2H2O=S↓+4OH-
(2)根据总反应方程式,放电时右侧的电解质储罐中Na2S2变为Na2S4,S元素化合价降低得到电子,该储罐为原电池的正极,Na+向该极移动;a极物质由NaBr3得到电子变为NaBr,电解反应式为Br3-+2e-=3Br‑;充电时b极物质由Na2S4得到电子变为Na2S2,电极反应式为S42- + 2e-=2S22-。
电解后得到银单质的量为n(Ag)=2.16÷108=0.02mol n(e-)=0.02mol
则溶液中OH-放电,n(H+)=n(OH-)=n(e-)=0.02mol,c(H+)=0.02÷0.2=0.1mol/L pH=1
(3)由表中第三组数据可知,溶液中HSO3-量多时,溶液显酸性,由于SO32-、HSO3-水解呈碱性,故只能是HSO3-在溶液中以电离为主溶液呈酸性,在HSO3-溶液中存在以下两个平衡HSO3-+ H2O H2SO3+OH-,HSO3-
H2SO3+OH-,HSO3- SO32-+H+,其中以电离为主,故溶液为酸性。
SO32-+H+,其中以电离为主,故溶液为酸性。
两溶液按1:1混合呈碱性,故需多加入少量HSO3-溶液才能转化为中性,NaHSO3量多于Na2SO3,故有
C(Na+)>C(HSO3-)>C(SO32-)>C(OH-)=C(H+)
