某校兴趣小组同学收集到含有硝酸银的溶液10g,他们利用铁锌合金回收其中的金属银,其实验过程如图所示。
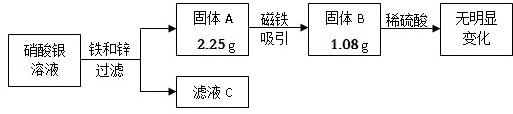
(1)固体A的成分是 (填化学式);滤液C中一定含有的溶质是 (填化学式)。
(2)写出铁与硝酸银反应的化学方程式: 。
(3)计算硝酸银的相对分子质量 ;原硝酸银溶液中溶质的质量为 。
(1)Ag和Fe;Zn(NO3)2;(2)Fe+2AgNO3=Fe(NO3)2+2Ag;(3)170;1.7g
题目分析:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸反应生成氢气.固体B中加入稀硫酸无现象,说明没有铁和锌,所以只能是银,固体A用磁铁吸引后变为固体B,说明固体A中含有铁和银,根据铁、锌和硝酸银的生成物考虑滤液的成分。
(1)固体B中加入稀硫酸无现象,说明没有铁和锌,所以只能是银,固体A用磁铁吸引后变为固体B,说明固体A中含有铁和银;将铁和锌放入硝酸银的溶液中,首先发生的反应是锌和硝酸银反应,再是铁和硝酸银反应,由于反应后的固体中没有锌,说明锌完全反应了,锌和硝酸银反应生成银和硝酸锌,所以滤液中一定含有硝酸锌;
(2)铁与硝酸银反应的反应物是铁和硝酸银,写在等号的左边,生成物是银和硝酸亚铁写在等号的右边,所以方程式是Fe+2AgNO3=Fe(NO3)2+2Ag;
(3)硝酸银的相对分子质量:108+14+16×3=170;设生成1.08g银需要硝酸银的质量为X,则
AgNO3﹣﹣﹣﹣﹣﹣Ag
170 108
X 1.08g
根据: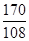 =
=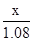
解得x=1.7g