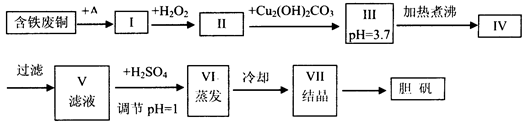
胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
pH值控制可参考下列数据
| 物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A可选用________(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的___________________________________________________。
(3)Ⅱ中加Cu2(OH)2CO3的目的是___________________________________,
其优点是_____________________________________________________________。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为___________________________。
(5)V中加H2SO4调节pH=1是为了_________________________________________,
某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是______________,
若你是工程师,将对所加的A物质作何改进?请提出建议______________________。
(1)b;(2分) (2)将亚铁离子氧化为铁离子;(2分) (3)除去过量的硫酸;不引入新的杂质;(2分)
(4)Fe3++3H2O Fe(OH)3↓+3H+;(2分)(5)抑制Cu2+的水解;(2分 )产生污染环境的二氧化硫,硫酸利用率低;(2分) 加热,并在稀硫酸中通入氧气。(注:本题为发散性试题,如有其它合理答案,酌情给分)(2分)
Fe(OH)3↓+3H+;(2分)(5)抑制Cu2+的水解;(2分 )产生污染环境的二氧化硫,硫酸利用率低;(2分) 加热,并在稀硫酸中通入氧气。(注:本题为发散性试题,如有其它合理答案,酌情给分)(2分)
题目分析:本道题是一道工艺流程题。将理论与实际结合的一种转化。往往这类题起点高,但是落点低。工艺流程看似复杂,但考查的只是主要是化学反应原理。一旦与流程结合,题目要求就比较高了。
在这题中是用废铜(主要是Cu,但含有少量Fe)来制取胆矾。通常除杂的方法:转化成易分离的物质。通常是气体或者是沉淀。在这里是Fe、Cu两种固体。根据题目所给信息,Fe是转化成沉淀(氢氧化物的形式)而Fe存在两种价态,+2、+3。根据题目中所给信息的话,通过比较Fe(OH)3和Fe(OH)2这两种物质:一个是开始沉淀时的pH值和完全沉淀时的pH值。可以判断出Fe(OH)3更容易沉淀,再结合Cu2+开始沉淀时的pH值,也可以得出使Fe转化为Fe(OH)3更容易除去。因此判断出将Fe转化为三家铁后,Cu最终要转化为胆矾(CuSO4·5H2O)。显然要将Cu溶解后到CuSO4中去。要将Cu完全溶解,所以使用的是浓H2SO4加热。在这个过程中不仅溶解Cu,还溶解Fe。Fe到FeSO4或Fe2(SO4)3或两者都有。所以为了确保Fe全转化为三价铁,再加入H2O2,目的是将二价铁转化为三价铁,在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,目的应是调节溶液的酸碱性,原溶液中为了确保Cu、Fe全部溶解,可能硫酸过量。所以这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7。刚好此时溶液中三价铁正全转化为Fe(OH)3。接下来加热煮沸的目的,使没沉淀下来的三价铁沉淀完全。当三价铁沉淀完全后,再进行过滤,滤液中剩余的阳离子主要有Cu2+,阴离子有SO42-。再加硫酸,调节溶液pH值=1,目的是抑制Cu2+的水解,再分别进行蒸发、冷却、结晶后,最终得到产品胆矾。
(1)A可选用浓H2SO4、加热,稀硫酸不能溶解Cu,而浓FeCl3溶液、浓HNO3会引入杂质。
(2)Ⅰ中加H2O2的目的将亚铁离子氧化为铁离子;H2O2与Fe2+发生氧化还原反应,Fe2+被氧化为Fe3+易除去。
(3)Ⅱ中加Cu2(OH)2CO3的目的是除去过量的硫酸;不引入新的杂质;
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为Fe3++3H2O Fe(OH)3↓+3H+;
Fe(OH)3↓+3H+;
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解;不调成强酸性溶液,在加热蒸发过程中,Cu2+水解加重。Cu与浓硫酸反应过程中会产生SO2,会对污染环境。所以可以向稀硫酸中不断通氧气(或者加H2O2)并加热。
