问题
计算题
将30g铁铜混合物与100g稀硫酸恰好完全反应,剩余物的总质量为129g,求:(1)混合物中铁的质量是多少?(2)稀硫酸溶液中溶质的质量分数是多少?(3)反应后所得溶液中溶质的质量分数又是多少?(相对原子质量Fe-56,S-32,O-16, H-1)
答案
28g 49% 59.8%
题目分析:(1)根据质量守恒定律得产生氢气的质量为(30g+100g)- 129g = 1g
解:设混合物中铁的质量是xg, 100g稀硫酸中硫酸的质量为yg,生成硫酸亚铁的质量为zg
Fe + H2SO4 = FeSO4 + H2 ↑
56 98 152 2
x y z 1
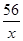 =
=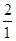
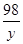 =
=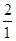
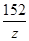 =
=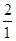
x = 28g y = 49g z = 76g
(2)稀硫酸溶液中溶质的质量分数= 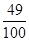 x 100% = 49%
x 100% = 49%
(3)反应后所得溶液中溶质FeSO4质量为76g,
反应后所得溶液的质量=(30g+100g)-1g-2g=127g
反应后所得溶液中溶质的质量分数=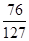 ×100% = 59.8%
×100% = 59.8%
