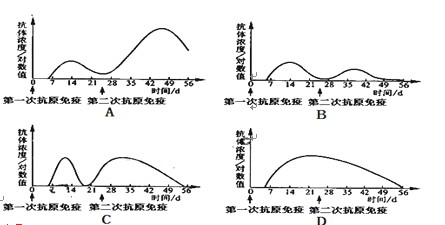
酸、碱、盐是化学工作者研究的重要领域,请回答下列各小题:(1)某二元酸H2X的电离方程式是:H2X=H++HX—,HX— X2—+H+。回答下列问题:
X2—+H+。回答下列问题:
①KHX溶液显 (填“酸性”、“碱性”或“中性”)。
②若0.1 mol·L—1KHX溶液的pH=2,则0.1 mol·L—1H2X溶液中氢离子的物质的量
浓度 (填“<”、“>”或“=”)0.11 mol·L—1,理由是 。
③0.01 mol·L—1的HCl与0.02 mol·L—1的KHX溶液等体积混合液中各离子浓度由大到小的顺序是
 (2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(3)在25℃下,有pH=3的醋酸溶液和pH=11的氢氧化钠溶液,其中氢氧化钠溶液的物质的量浓度是 ,醋酸溶液的物质的量浓度 (填“>”、“<”、“=”)氢氧化钠溶液物质的量浓度。将上述两溶液等体积混合,反应后溶液显 (填“酸”、“碱”、“中”)性。
(4)某强酸性反应体系中,发生反应:
X+ PbO2+ H2SO4 = Pb(MnO4)2+ PbSO4+ H2O ,
已知X是一种硫酸盐,且0.2 mol X在该反应中失去1 mol 电子,则X的化学式是
。请将上述化学方程式配平,把系数填在各物质前的横线上。.
29.(14分)
(1)①酸性(1分)
②< (1分) H2X第一步电离产生的H+对HX—的电离起了抑制作用(2分)
③c(K+)>c(HX—)>c(H+)> c(Cl—)>c(X2—)>c(OH—) (2分)
(2)Fe(OH)3(1分)
(3)0.001 mol·L—1(1分) >(1分) 酸(1分)
(4)2X+5PbO2+2H2SO4 = Pb(MnO4)2+4PbSO4+2H2O (2分)
MnSO4(2分)
题目分析:
(1)①某二元酸H2X的电离方程式是:H2X=H++HX—,HX—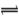 X2—+H+。第一步是完全电离,第二步是可逆反应,说明是HX—弱电解质,因此HX—只能电离呈酸性;
X2—+H+。第一步是完全电离,第二步是可逆反应,说明是HX—弱电解质,因此HX—只能电离呈酸性;
②H2X是强电解质,第一步是完全电离所以溶液中氢离子的物质的量浓度比较大。
③0.01 mol·L—1的HCl与0.02 mol·L—1的KHX溶液等体积混合液中各离子浓度由大到小的顺序是c(K+)>c(HX—)>c(H+)> c(Cl—)>c(X2—)>c(OH—)
(2)由于Fe(OH)3的KSP比较小,当OH-浓度相同时首先沉淀的是Fe(OH)3。
(3)由于醋酸是弱酸,虽然H+和OH-浓度开始相同时,醋酸的物质的量浓度应该比较大,等体积中和之后酸是过量的,所以呈酸性。
(4)根据电子守恒和原子守恒不难得出2X+5PbO2+2H2SO4 = Pb(MnO4)2+4PbSO4+2H2O X应该是MnSO4。