在一烧杯中盛有24.3g Na2SO4和NaCl组成的固体混合物,加入100g水使Na2SO4和NaCl全部溶解。向其中逐渐滴加溶质质分数为20%的氯化钡溶液,生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图所示。
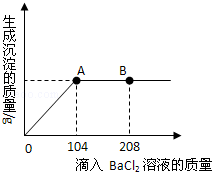
(1)请分析当BaCl2溶液滴加到B点时,溶液中的溶质是 。
(2)请计算当滴加BaCl2溶液至图中A点时,所得溶液的溶质质量分数(计算结果保留一位小数)。
(1)BaCl2 NaCl (2)10.6%
题目分析:(1)当沉淀的质量不再增加时,说明反应已经进行完毕,所以当BaCl2溶液滴加到B点时说明氯化钡溶液滴加过量,当BaCl2溶液滴加到B点时,溶液中的溶质有刚生成的氯化钠和原来的氯化钠以及过量的氯化钡。
(2)根据当滴加BaCl2溶液至图中A点时沉淀的质量不再增加说明氯化钡溶液和硫酸钠溶液恰好完全反应,利用氯化钡的质量求出生成氯化钠的质量以及沉淀的质量即可求出所得溶液的溶质质量分数。
解:设参加反应的硫酸钠的质量为x,生成的硫酸钡的质量为y,生成的氯化钠的质量为z
BaCl2 + Na2SO4=2NaCl+BaSO4↓
208 142 117 233
104g×20% x z y
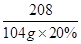 =
=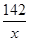
解得x=14.2g
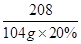 =
=
解得y=23.3g
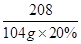 =
=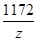
解得z=11.7g
当滴加BaCl2溶液至图中A点时,所得溶液的溶质质量分数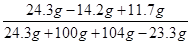 ×100%=10.6%
×100%=10.6%
答:当滴加BaCl2溶液至图中A点时,所得溶液的溶质质量分数为10.6%
