问题
计算题
铜镁合金具有优良的导电性,常用作飞机天线等导电材料.欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下.请计算:
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 70 | 70 | 70 | 70 |
| 剩余固体质量/g | 18.2 | 16.4 | 14.6 | 13.2 |
(1)合金中铜、镁的质量比.
(2)所加稀硫酸的溶质的质量分数.(写出计算过程)
答案
(1)33:17 (2)10.5%
题目分析:(1)剩余固体的质量为铜的质量,所以铜的质量为13.2g,金属镁的质量=20g﹣13.2g=6.8g,合金中铜、镁的质量比=13.2:6.8=33:17;
(2)分析表中数据可知,与70g稀硫酸完全反应消耗镁的质量为1.8g.
设与1.8g金属镁反应的稀硫酸的溶质的质量为x.
Mg+H2SO4═MgSO4+H2↑
24 98
1.8g x
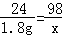
x=7.35g
所加稀硫酸的溶质的质量分数= ×100%=10.5%
×100%=10.5%
答:所加稀硫酸的溶质的质量分数10.5%.
点评:本题难度一般,但综合性强,以信息给予题的形式考查了金属的化学性质、质量守恒定律的应用等,完成此题可以依据已有的知识进行.