工业上侯氏制碱法得到的纯碱产品中常含有少量的氯化钠杂质,化验员要对每批次的纯碱产品进行检验.在实验室中取27g纯碱样品,平均分成五份依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表:
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平的示数/g | 163.2 | 166.4 | 169.6 | 175 | 180.4 |
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是 g.
(2)计算纯碱样品中碳酸钠的质量分数是多少?(计算结果精确到0.1%)
(3)计算所用稀盐酸的质量分数是多少?
(1)2.2 (2)98.1% (3)10.95%
题目分析:(1)根据质量守恒定律,第一次加入纯碱样品充分反应后,生成二氧化碳的质量=100g+60g+5.4g﹣163.2g=2.2g
故答案为:2.2;
(2)第三次加入纯碱样品充分反应后与100g盐酸恰好完全反应,共生成二氧化碳的质量=5.4g×3+100g+60g﹣169.6g=6.6g
设前三次样品中含有碳酸钠的质量为x,所用稀盐酸中溶质的质量为y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y 6.6g
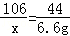
x=15.9g
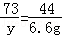
y=10.95g
纯碱样品中碳酸钠的质量分数=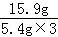 ×100%=98.1%
×100%=98.1%
答:纯碱样品中碳酸钠的质量分数是98.1%.
(3)所用稀盐酸的质量分数=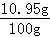 ×100%=10.95%
×100%=10.95%
答:所用稀盐酸的质量分数是10.95%.
点评:根据第三次实验数据加入稀盐酸后剩余物质质量不再改变可知得,此时所加入的稀盐酸不再反应,碳酸钠完全反应,反应放出二氧化碳的总质量可由质量守恒定律求得
