问题
计算题
下图为某浓盐酸的商标。计算回答下列问题:

(1)某研究小组的同学欲用该盐酸配制50mL7.3%的稀盐酸(此稀盐酸的密度取1.0g/mL),需要该浓盐酸_______g。(计算结果保留整数)
(2)用上述所配制稀盐酸测定氢氧化钠的含量。具体操作是:在被测的一定量的氢氧化钠溶液中逐滴加入上述所配制的稀盐酸,并测量不同时间溶液的pH,记录数据如下表:
| 反应时间(秒) | 0 | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 |
| 滴入稀盐酸体积(mL) | 0 | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 |
| pH | 13.2 | 13.0 | 12.7 | 12.4 | 12.1 | 7.0 | 2.0 | 1.6 | 1.3 |
①观察上表发现,当反应时间在_________秒时,氢氧化钠与盐酸恰好完全中和;
②结合上表中滴入盐酸体积与pH的变化数据,试计算被测氢氧化钠溶液中溶质的质量。(计算结果精确至0.1g)
答案
(1)10
(2)①125 ②1.6g
题目分析:(1)用该盐酸配制50mL7.3%的稀盐酸时,溶质的质量不变。即需要浓盐酸的质量为:50mL╳1.0g/mL╳7.3%÷36.5%=10g
(2)①当pH=7时,说明氢氧化钠与盐酸恰好完全中和。因此反应时间应为125秒时。
②已知:加入盐酸的质量;未知:氢氧化钠的质量
解题思路:可通过二者在反应中的质量关系求解。
解题过程:解:恰好中和时参加反应的HCl的质量=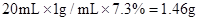
设:氢氧化钠溶液中溶质的质量为x 设未知量
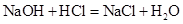
40 36.5
x 1.46g
40/36.5=x/1.46g
X=1.6g
答:溶液中氢氧化钠的质量为1.6g
