问题
计算题
某同学对实验室中失去标签的石灰石样品进行纯度(样品中碳酸钙的质量分数)测定,取这种石灰石样品12.5g,加入94.4g一定质量分数的稀盐酸.充分反应后,共收集到4.4g二氧化碳气体(石灰石中的杂质既不溶于水,也不和稀盐酸反应).求:
(1)石灰石样品中碳酸钙的质量分数.
(2)反应后所得溶液中溶质的质量分数.
答案
(1)80% (2)11.1%
题目分析:(1)设石灰石中碳酸钙的质量为x,生成的氯化钙的质量为y,则
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
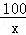 =
=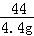 ,解得x=10g;
,解得x=10g;
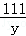 =
=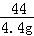 ,解得y=11.1g;
,解得y=11.1g;
该样品中碳酸钙的质量分数为 ×100%=80%;
×100%=80%;
答:石灰石样品中碳酸钙的质量分数80%;
(2)因杂质既不溶于水,也不与其他物质反应,则溶液的质量为10g+94.4g﹣4.4g=100g,溶质的质量为11.1g,
则溶质的质量分数为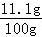 ×100%=11.1%.
×100%=11.1%.
答:反应后所得溶液中溶质的质量分数为11.1%.
点评:本题考查学生利用化学反应方程式的计算,明确二氧化碳是气体并利用质量守恒来计算二氧化碳的质量是解答的关键.
