问题
选择题
在0.1mol/LNaHCO3溶液中,下列各关系式正确的是 ( )
A.[Na+]>[HCO3-]>[H+]>[OH-]
B.[Na+]+[H+]=[OH-]+[HCO3-]+2[CO32-]
C.[Na+]=[HCO3-]>[OH-]>[H+]
D.[Na+]=[HCO3-]+[CO32-] +[H2CO3]
答案
BD
在解答离子浓度大小的问题时,要注意盐的电离规律和盐类的水解规律,应用溶液中的几个守恒关系来准确的解答题目。在NaHCO3溶液中存在如下平衡:HCO3-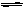 CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O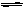 H2CO3+OH-;溶液中存在Na+,HCO3-,CO32-,OH-和H+等五种离子,根据阴、阳离子的电荷守恒,B选项正确。由于HCO3-的水解程度大于其电离程度,即[OH-]>[H+],则A不正确。由于HCO3-的水解,使得[Na+]>[HCO3-],故C不正确。又根据NaHCO3中Na+与HCO3-的个数比为1:1,根据原子守恒:[Na+]=[HCO3-]+[CO32-] +[H2CO3],D正确
H2CO3+OH-;溶液中存在Na+,HCO3-,CO32-,OH-和H+等五种离子,根据阴、阳离子的电荷守恒,B选项正确。由于HCO3-的水解程度大于其电离程度,即[OH-]>[H+],则A不正确。由于HCO3-的水解,使得[Na+]>[HCO3-],故C不正确。又根据NaHCO3中Na+与HCO3-的个数比为1:1,根据原子守恒:[Na+]=[HCO3-]+[CO32-] +[H2CO3],D正确
