湿法冶金是我国古代劳动人民智慧的结晶.若向ag含杂质的铁粉中(假设杂质不溶于水,也不与其他物质反应)加入l60g溶质的质量分数为l0%的硫酸铜溶液,恰好完全反应后,过滤得到6.8g干燥固体,同时得到一种不饱和溶液(滤液损失忽略不计).
请回答下列问题:
(1)写出上述反应的化学方程式 ;
(2)根据硫酸铜质量列出求解样品中铁的质量(x)的比例式 ;
(3)a的数值为 ;
(4)若向反应后的滤液中加入40.8g水,则所得溶液中溶质的质量分数为 ;
(5)工业上若要得到120t上述铁粉,需要含杂质(杂质不含铁元素)20%的赤铁矿的质量是 .
(1)Fe+CuS04=Cu+FeSO4;(2)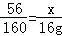 ;(3)6;(4)7.6%;(5)200t.
;(3)6;(4)7.6%;(5)200t.
题目分析:(1)湿法冶金的原理是:铁与硫酸铜反应生成了硫酸亚铁和铜,反应的方程式是:Fe+CuS04=Cu+FeSO4;
(2)硫酸铜的质量为l60g×l0%=16g
设生成的铜的质量为y、硫酸亚铁的质量为z
Fe+CuS04=FeSO4+Cu;
56 160 152 64
x l6g z y
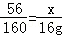 解得x=5.6g
解得x=5.6g
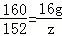 解得:z=15.2g
解得:z=15.2g
 解得:y=6.4g
解得:y=6.4g
(3)由题可知:a=5.6g+(6.8g﹣6.4g)=6g
(4)所得溶液中溶质的质量分数为: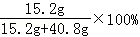 =7.6%
=7.6%
(5)铁的质量为:120t×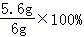 =112t
=112t
设需要赤铁矿石的质量为m.
Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
160 112
m(1﹣20%) 112t
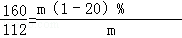 解得:m=200t
解得:m=200t
点评:本题的综合性较强,比较全面地考查了化学方程式的书写、化学方程式的计算、溶液质量分数的计算,含杂质的化学方程式的计算等,只有全面地掌握了有关的化学计算才能较好地完成本题.
