25℃时,0.01 mol·L-1两种弱酸溶液的pH如表,下列说法正确的是

A.相同pH的两种酸溶液中,CH3COOH溶液中水电离的c(H+)较大
B.物质的量浓度相同的CH3COONa与NaCN 溶液中,CH3COONa溶液pH较大
C.等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH
D.HCN的电离平衡常数(Ka)与CN—的水解平衡常数(K)存在如下关系:Ka•K=Kw
答案:D
题目分析:A、pH相同,两种酸溶液的c(OH—)相同,则水电离的c(OH—),因此水电离的c(H+)也相同,错误;B、由已知条件可知,电离程度:CH3COOH>HCN,则水解程度:CH3COONa<NaCN,则CH3COONa溶液pH较小,错误;C、pH相同时,c(CH3COOH)<c(HCN),由c•V可知,n(CH3COOH)<n(HCN),故HCN消耗的NaOH较多,错误;D、Ka=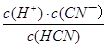 ,K=
,K=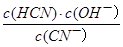 ,Kw=c(H+)•c(OH—),故Ka•K=Kw,正确。
,Kw=c(H+)•c(OH—),故Ka•K=Kw,正确。