为测定黄铜(锌铜合金)样品的组成,某同学取四个样品分别加稀硫酸做了四次实验,其实验数据记录如下表..
| 实验次数 | l | 2 | 3 | 4 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)反应的化学方程式
(2)列出计算黄铜中参加反应的金属质量(X)的比例式:
(3)参加反应的稀硫酸的溶质质量分数
(4)向第一次实验所得溶液中加入47.4g水,溶液中溶质的质量分数
(5)若工业上用125t含Cu2S 70%的辉铜矿炼制该黄铜,理论上能炼制出黄铜的质量为 。
(1)Zn+H2SO4═ZnSO4+H2↑ (2) =
=  (3)49%
(3)49%
(4)32.2% (5)200 t.
题目分析:(1)锌和稀硫酸反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑.
(2)完全反应生成氢气的质量是1.0g,锌的质量为X,
Zn+H2SO4═ZnSO4+H2↑,
65 2
X 1.0g
 =
= .
.
X=32.5g,
(3)根据第1次实验数据计算,稀硫酸和足量锌反应能生成0.4g氢气,
设40.0g稀硫酸中硫酸的质量为Y,参加反应的锌的质量为Z,生成硫酸锌的质量为m,
Zn+H2SO4═ZnSO4+H2↑,
65 98 161 2
Z Y m 0.4g
 =
= ,
, =
= ,
,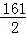 =
= ,
,
Y=19.6g,Z=13g,m=32.2g,
参加反应的稀硫酸的溶质质量分数为: ×100%=49%;
×100%=49%;
(4)向第一次实验所得溶液中加入47.4g水后,溶液的质量为:40.0g+13g+47.4g﹣0.4g=100g,
溶液中溶质的质量分数为: ×100%=32.2%.
×100%=32.2%.
(5)125t含Cu2S 70%的辉铜矿中铜的质量为:125t×70%× ×100%=70t,
×100%=70t,
由(2)中可知,50g黄铜中铜的质量为:50g﹣32.5g=17.5g,
黄铜中铜的质量分数为: ×100%=35%,
×100%=35%,
理论上能炼制出黄铜的质量为:70t÷35%=200t.
