问题
计算题
实验室有瓶存放一段时间的氢氧化钠固体,部分已变质为碳酸钠.取2.00g该固体,先加水充分溶解,再加入足量澄清石灰水,生成1.00g碳酸钙沉淀.计算:
(1)2.00g该固体中碳酸钠的质量;
(2)该氢氧化钠固体的变质程度.(计算结果保留到1%)
(提示:氢氧化钠的变质程度是指已变质的氢氧化钠占变质前氢氧化钠的质量分数)
答案
(1)2.00g该固体中碳酸钠的质量为1.06g;(2)该氢氧化钠固体的变质程度为46%.
题目分析:(1)设碳酸钠的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 1.00g
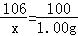
x=1.06g
(2)设变质的氢氧化钠的质量为y.
2NaOH+CO2=Na2CO3+H2O
80 106
y 1.06g
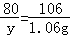
y=0.8g
该氢氧化钠固体的变质程度=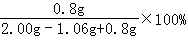 =46%
=46%
答:(1)2.00g该固体中碳酸钠的质量为1.06g;(2)该氢氧化钠固体的变质程度为46%.