某化工厂生产的纯碱产品(含有少量氯化钠)的包装袋上注明:碳酸钠≥96%.
为了测定该产品中碳酸钠的质量分数是否属实,向4个分别盛有浓度相同、质量均为100g稀盐酸的烧杯中,分别放入不同质量的纯碱产品,充分反应后,称量烧杯中剩余物的质量,实验数据如下表:
| 所称量的物质 | 实验1 | 实验2 | 实验3 | 实验4 |
| 加入纯碱产品质量/g | 2.8 | 5.6 | 11.2 | 14 |
| 烧杯中剩余物质量/g | 101.7 | 103.4 | 106.8 | 109.6 |
请计算(最后结果保留一位小数):
(1)该纯碱产品中碳酸钠质量分数的标注是否真实.
(2)所用盐酸溶液中溶质的质量分数.
(3)恰好完全反应时,所得溶液中溶质的质量分数.
题目分析:盐酸完全反应时,生成二氧化碳的质量为100 g﹢11.2 g﹣106.8 g﹦4.4 g.
设:纯碱产品中碳酸钠质量为x,稀盐酸中溶质的质量为y,生成氯化钠的质量为z.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y z 4.4 g
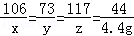
x="10.6" g y="7.3" g z="11.7" g
(1)纯碱产品中碳酸钠的质量分数= 标注不真实.
标注不真实.
(2)盐酸溶液中溶质质量分数=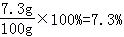
(3)氯化钠溶液中溶质质量分数=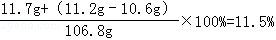
答:(1)该纯碱产品中碳酸钠质量分数的标注不真实.
(2)所用盐酸溶液中溶质的质量分数为7.3%.
(3)恰好完全反应时,所得溶液中溶质的质量分数为11.5%.
