某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示。
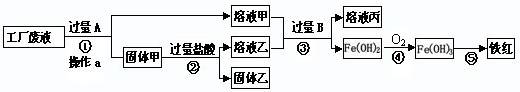
回答下列问题:
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。
(2)工厂废液中加入过量A反应的化学方程式为 。
(3)固体乙的主要成分是 。
(4)铁红是炼铁的主要原料,用CO和铁红炼铁的化学方程式为 。
(5)某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中
称取生铁样品5.8g放入烧杯中,然后再加入足量的稀硫酸,使之充分反应后,共收
集到0.2g氢气(杂质不参加反应)。则该生铁样品中铁的质量分数为 。(列出计算过程,保留一位小数。)
1)引流
(2)Fe+CuCl2 = FeCl2+Cu
(3)铜
(4)3CO+ Fe2O3 2Fe+3CO2
2Fe+3CO2
(5)96.6%
题目分析:
经过操作a得到了固体和液体,即操作a是过滤操作,过滤时要用玻璃棒引流;
废液中含有氯化钠、氯化铜和氯化亚铁,要把氯化铜除去又不引入其他金属元素可加入铁粉利用置换反应把铜置换出来后过滤除去,即Fe+CuCl2 = FeCl2+Cu
(3)炼铁的主要原料是一氧化碳和氧化铁,反应生成铁和二氧化碳:
3CO+ Fe2O3 2Fe+3CO2
2Fe+3CO2
(4)生铁是铁合金,除铁外还含有碳等物质;生铁样品中加入足量的稀硫酸是铁和硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑;利用化学方程式中铁与氢气的质量比,结合氢气的质量,可求出样品中铁的质量。
设参加反应的铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.2g
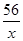 =
=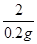
解得:x=5.6g
生铁中铁的质量分数=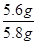 ×100%=96.6%
×100%=96.6%
