钙是维持人体正常功能所必需的元素。钙尔奇是常用的补钙剂,主要成分是CaCO3,钙尔奇每片2.0g。取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应)。烧杯内物质质量变为11.34g。试计算:
(1)反应产生二氧化碳 g,是 mol;
(2)每片钙尔奇中含碳酸钙 mol;
(3)服用钙尔奇通常一日2次,每次1片。则每人每天摄入钙元素的质量为 g。
(4)根据化学方程式列式计算上述反应所用稀盐酸溶质的质量分数(精确到0.01%)
(1)0.66 0.015 (2)0.015 (3)1.2 (4)10.95% (1分)
试题解析:(1)由质量守恒定律可知,反应前物质的总质量等于反应后物质的总质量:生成二氧化碳的质量为:2g+10g-11.34g="0.66" g
0.66 g的摩尔数是0.66 g÷44g/ mol="0.015" mol
(2)由化学方程式CaCO3 +2HCl →CaCl2 +H2O + CO2↑可知,每片钙尔奇中含碳酸钙碳酸钙0.015mol
(3)每人每天摄入钙元素的质量为2×0.015×100×40﹪=1.2g
(4)设:盐酸中氯化氢为x mol
CaCO3 +2HCl →CaCl2 +H2O + CO2↑(1分,化学式正确就得分)
1 2
0.015 x
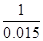 =
= 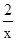 (1分) x =" 0.03" mol (1分)
(1分) x =" 0.03" mol (1分)
盐酸的质量分数=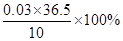 = 10.95%
= 10.95%