(2014届南京市秦淮区第一学期期末试题)(10分)铁矿石冶炼成铁是一个复杂的过程。炼铁的原理是利用一氧化碳与氧化铁的反应,该化学方程式为 。
(1)某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,该厂理论上可以日产含铁98%的生铁的质量是多少?(请写出计算过程,结果精确到0.1t)
(2)某化学兴趣小组在实验室中模拟炼铁原理的实验,并对固体产物的成分进行探究。

[设计实验] 用一氧化碳还原纯净的氧化铁粉末,实验装置如右图,酒精灯b的作用是 。
[进行实验]该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)。
②反应后玻璃管和内盛黑色固体的总质量m(冷却到室温称量)。
[分析与讨论]本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
[查阅资料]
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
③
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 。
②该小组同学将黑色固体粉末投入硫酸铜溶液中,一段时间后无紫红色固体析出,则该黑色固体粉末为 。其实,进行如上图所示实验后,若测得反应后玻璃管和内盛黑色固体的总质量m为 g,也能得出这个结论。
[反思与评价]一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间。上图所示实验装置中,应作的一处修改是 。
3CO+Fe2O3高温2Fe+3CO2 (1)2714.3t (2)【设计实验】尾气处理,防止空气污染
[进一步实验和得出结论]①氧化亚铁 ②四氧化三铁 65.8g
[反思与评价]将酒精灯a换成酒精喷灯
题目分析:(1)设生铁质量为X
3CO+Fe2O3高温2Fe+3CO2
160 112
5000t×76% 98%X
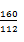 =
= 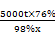
X=2714.3t
(2)[进一步实验和得出结论]①根据表格提供信息,不能被磁铁吸引的除氧化铁外,还有氧化亚铁。②根据题意,该粉末不能置换出硫酸铜溶液中的铜,则该黑色粉末不是铁粉,从而该粉末只能是四氧化三铁。后半题实际是问:如果生成四氧化三铁,则反应后会有多少固体物质存在呢?为此,我们可以先列出反应方程式,并通过方程式求解,具体过程如下:
设生成四氧化三铁质量为X
CO+3Fe2O3高温2Fe3O4+CO2
3×160 2×232
(66-60)g X
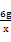 =
= 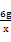
X=5.8g
反应后玻璃管和内盛黑色固体的总质量m为60g+5.8g=65.8g时,也能得出只生成四氧化三铁这一结论。
[反思与评价]根据题意,要提高反应温度,只有将酒精灯a换成酒精喷灯,当然也可以给酒精灯加上网罩,以使火焰集中,从而提高温度。不过这样的效果可能不如换用酒精喷灯好。
